Чотири роки тому всесвітньо відоме видання Science у підсумковому номері назвало досягнення в галузі імунотерапії проривом року — настільки вразили науковців результати ранніх фаз клінічних досліджень інгібіторів сигнальних шляхів PD-1/PD-L1 при меланомі, раку легень та раку нирок, тривалого спостереження пацієнтів з меланомою, а також ефективність інших інгібіторів контрольних точок [1].
Імунотерапія дала початок новим стратегіям боротьби з онкологічними захворюваннями, оскільки основна дія цього методу спрямована на імунні клітини, а не на саму пухлину.
Та все ж імунотерапія — не настільки новий метод, як здається на перший погляд: її основна концепція була сформульована понад століття тому. Однак за цей час імунотерапія раку пройшла шлях від суто емпіричних до молекулярно обґрунтованих підходів. Можна навіть сказати, що імунотерапія починаючи від моменту зародження до визнання подолала у своєму розвитку найтриваліший шлях — порівняно з іншими методами лікування, котрі застосовують в онкології. Втім, головне те, що не лише науковці, а й усе суспільство змогло, нарешті, побачити ці вражаючі результати.
«Стародавній» метод імунотерапії
Вважається, що засновником методу імунотерапії раку був американський хірург Вільям Коулі, який вивчав описані в літературі випадки спонтанного регресу злоякісних новоутворень на тлі гострих інфекцій. Для практичних експериментів він вибрав одну із досить поширених на той час інфекцій — повзучу еритему (еризепелоїд, або свиняча пика): кількох хворих із саркомами він заразив збудниками еризепелоїду, бактеріями Erysipelotrix rhusiopathiae. За певний час Вільям Коулі отримав позитивний результат: злоякісні пухлини зменшилися. Так з’явилася перша протипухлинна вакцина [2].
Лікар не залишав надії перемогти рак остаточно й протягом наступних років провів випробування із застосуванням різноманітних штамів патогенних бактерій за участю близько тисячі пацієнтів, у яких було діагностовано переважно саркоми м’яких тканин і кісток. Приблизно в 10% добровольців він отримував клінічно значущі результати, і в деяких випадках регрес пухлин був настільки вираженим і тривалим, що методику лікування американського хірурга можна було б одразу визнати клінічно обґрунтованою. Проте, на жаль, цього не сталося. Навпаки, Вільям Коулі зазнав нищівної критики, а деякі вчені навіть звинувачували його у шахрайстві [3].
На щастя, це його не зупинило, і Вільям Коулі вказав на кілька вирішальних для виживання пацієнта моментів. Основним фактором була симуляція природної гострої інфекції, яка б супроводжувалася істотним підвищенням температури тіла. Ін’єкції робили щодня або через день протягом першого місяця чи двох. Щоб уникнути імунної толерантності до вакцини, дозування поступово збільшували, але обов’язково залежно від індивідуальної реакції пацієнта. Вакцину вводили безпосередньо в первинну пухлину і (якщо це було можливо) в метастази. Для запобігання рецидивам проводили ще один 6-місячний курс щотижневих ін’єкцій.
Проте, незважаючи на досягнуті результати, колеги не підтримали методи Вільяма Коулі, а сам лікар так і не зміг їх науково обґрунтувати. Тому, на жаль, метод імунотерапії раку не здобув підтримки в наукових колах, яка дала б йому змогу розвиватися далі. До того ж після смерті Вільяма Коулі були розроблені нові методи радіо- і хіміотерапії, визнані науковим співтовариством набагато перспективнішими. На щастя, спроби засновника протипухлинної імунотерапії не були забуті іншими вченими.
Спонтанна регресія як поштовх до досліджень
 Феномен спонтанної регресії пухлин (його частота не така вже й низька — 1 випадок на 80 тис. пацієнтів) вивчався і надалі. У XX столітті було визначено, що найчастіше феномен спонтанної регресії пухлин відбувається у дітей і при певних формах раку (хоріонепітеліомі, раку молочної залози, нейробластомі, саркомах, аденокарциномі нирки, раку сечового міхура та шкіри, у т. ч. меланомі).
Феномен спонтанної регресії пухлин (його частота не така вже й низька — 1 випадок на 80 тис. пацієнтів) вивчався і надалі. У XX столітті було визначено, що найчастіше феномен спонтанної регресії пухлин відбувається у дітей і при певних формах раку (хоріонепітеліомі, раку молочної залози, нейробластомі, саркомах, аденокарциномі нирки, раку сечового міхура та шкіри, у т. ч. меланомі).
Спонтанна регресія пухлин не випадкова — вона має свої причини і пов’язана з активацією імунної системи, що відбувається за умов серйозного стресу. Гострі інфекції та підвищення температури тіла негайно спричиняють ефективну імунну відповідь, котра вражає як збудників, так і пухлини одночасно. (Ще Вільям Коулі вказував на те, що потужна фебрильна реакція була симптомом, найтісніше пов’язаним із регресією пухлини.)
Більш сучасні дослідження показали, що дисфункції імунної системи є основною перешкодою спонтанного зцілення від раку. Імунна некомпетентність у таких випадках може бути пов’язана з двома факторами:
- здатністю злоякісних клітин уникати імунного нагляду (уже досить відомим на той час явищем);
- імунодефіцитом пацієнта (у т. ч. таким, що виник унаслідок хіміотерапевтичного лікування).
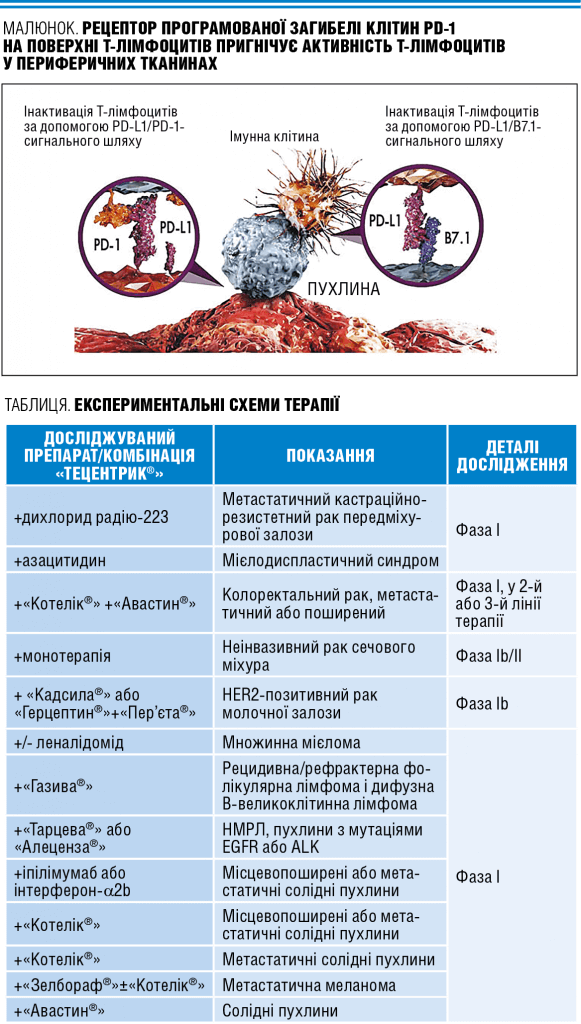
Це були основні перешкоди до впровадження методу імунотерапії, який у XX столітті нарешті визнали перспективним. Через якийсь час з’ясувалося, що пухлини часто уникають імунного нагляду, впливаючи на так звані контрольні точки — специфічні сигнальні молекули на поверхні лімфоцитів (кілерів), котрі можуть як пригнічувати, так і активувати імунну відповідь. Нова інформація дала вченим змогу розвивати методи імунотерапії раку більш цілеспрямовано та ефективно (див. малюнок).
Поворотний момент
Критичною подією, яка спричинила бурхливий розвиток досліджень у цій галузі, стало відкриття в 1995 році активуючого впливу на розвиток Т-клітинної відповіді блокади рецептора CTLA-4 [4]. Це повністю змінило погляд вчених на імунотерапію: адже якщо раніше для знищення пухлини імунну відповідь намагалися стимулювати, то після цього вчені спрямували свої зусилля на елімінацію чинників, які пригнічують імунну відповідь.
Таким чином, для запобігання явищу уникнення пухлиною імунного нагляду були розроблені два класи препаратів — інгібіторів імунних контрольних точок, які впливають на рецептори CTLA-4 і PD-1.
Далі припустили, що використання ліганду рецептора PD-L1 у якості терапевтичної мішені супроводжуватиметься меншою токсичністю завдяки селективній модуляції імунної відповіді в мікрооточенні пухлини. Дослідження підтвердили доцільність цієї ідеї: блокування PD-1 і PD-L1 дає подібні клінічні результати, проте блокування PD-L1 пов’язано з меншим ризиком розвитку аутоімунних реакцій (адже стимуляція імунних клітин загрожує їх надмірною гіперактивністю, тоді як тонкий механізм активації впізнавання злоякісних клітин безпечніший у цьому відношенні).
Компанія Roche розробила та зареєструвала «Тецентрик®» (атезолізумаб) — перший препарат на основі моноклональних антитіл, специфічних до протеїну PD-L1, який експресується на клітинах пухлини й імунних клітинах, що її інфільтрують. Зв’язуючись із PD-L1, «Тецентрик®» запобігає взаємодії цього протеїну з PD-1, а також із рецептором В7.1 на поверхні Т-лімфоцитів, що допомагає відновити ефективну протипухлинну імунну відповідь.
Інакше кажучи, імуноонкологічний препарат «Тецентрик®» пригнічує активність ліганду PD-L1, а це у свою чергу активує Т-лімфоцити, відновлюючи їх здатність ефективно виявляти й атакувати неопластичні клітини. Цей підхід дає змогу застосовувати один препарат при різних видах злоякісних пухлин, які для уникнення імунної відповіді використовують сигнальний шлях PD-1/PD-L1 й тканини яких інфільтровані лімфоцитами.
Наразі українські пацієнти з метастатичним раком легень і пухлинами сечового міхура мають змогу лікуватися атезолізумабом, у тому числі в рамках клінічних досліджень. Дослідження показали, що виживаність хворих, які отримували «Тецентрик®», сягає понад 20 місяців [5]. Наразі «Тецентрик®» зареєстрований в Україні для лікування метастатичного немілкоклітинного раку легень та уротеліальної карциноми, але, можливо, спектр його показань незабаром розшириться — це покажуть клінічні дослідження (див. таблицю).
Література
1. Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy // Science. 2013. Vol. 342, No. 6165. P. 1432-1433.
2. Coley W.B. II. Contribution to the Knowledge of Sarcoma // Ann Surg. 1891. Vol. 14, No. 3. P. 199-220.
3. McCarthy E.F. The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas // Iowa Orthop J. 2006; 26:154-8. PMID: 16789469.
4. 39. Krummel M.F., Allison J.P. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation // J Exp Med. 1995. Vol. 182, No. 2. P. 459-465.
5.Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial.
// The Lancet. Vol. 389, No. 10066 (21 January 2017).











