Зараз фахівці більшості спеціальностей вже мають досвід роботи з пацієнтами, які перенесли COVID-19. На жаль, треба визнати, що після одужання більшість пацієнтів ще довго стикається з наслідками хвороби.
Легеневий фіброз є однією з найбільш поширених проблем такого роду, говорить доцент кафедри фтизіатрії та пульмонології НМУ імені О.О.Богомольця, медичний директор ГО «Інфекційний контроль в Україні» Марія Долинська.
Симптом матового скла
 Марія ДОЛИНСЬКА, доцент кафедри фтизіатрії та пульмонології НМУ імені О.О.Богомольця, медичний директор ГО «Інфекційний контроль в Україні»
Марія ДОЛИНСЬКА, доцент кафедри фтизіатрії та пульмонології НМУ імені О.О.Богомольця, медичний директор ГО «Інфекційний контроль в Україні» Зміни в легенях по типу матового скла, що є проявами пневмофіброзу, стали ознакою пневмонії на тлі COVID-19, яка добре відома навіть не медикам. Така картина на КТ разом з типовими клінічними проявами дозволяє поставити діагноз захворювання навіть за негативних результатів ПЛР, адже недостатня чутливість ПЛР відома [1].
Такий підхід зафіксований і для шифрування COVID-19 у МКХ-10: U 07.2 – коронавірусна інфекція COVID-19, що діагностується клінічно або епідеміологічно, якщо лабораторні обстеження непереконливі чи недоступні (вірус не ідентифікований) [2]. Симптом матового скла є відображенням інтерстиціального фіброзу, наслідку гострого респіраторного дистрес-синдрому (ГРДС) будь-якої етіології. Заміщення інтерстицію легень сполучною тканиною пов’язують з «цитокіновим штормом», зокрема викидом IL-6 і TNF. Тож, з певними обмеженням можна сказати, що чим тяжче перебіг хвороби і більше об’єм ураженої паренхіми, тим сильніше виражений фіброз [3].
Дізнайтеся більше: COVID-19 вражає легені більше, ніж вважалося раніше.
Як швидко формується фіброз тканин і чи впливає він на об’єм легень?
Запальний процес у легенях практично одразу переходить у більш чи менш грубий пневмофіброз, тож питання полягає не в тому, як швидко розвивається фіброз, а в тому, скільки він триває і до яких функціональних змін призводить. Зрозуміло, що наразі можна говорити лише про дуже ранні результати. Наприклад, відомо, що 47% пацієнтів після стаціонарного лікування мають зниження дифузійної здатності легень по моноксиду карбону (ДЗЛ СО) та у 25% реєструється зниження життєвої ємності легень (ЖЄЛ) [4].
Однак ставити знак рівності між ретикулярними змінами, що ми бачимо на КТ одразу після одужання, функціональними порушеннями та незворотним фіброзом не завжди можна. Потрібно багато років спостереження для того, щоб дізнатися, наскільки фіброз після COVID-19 прогресуватиме і чи призведе до функціональної недостатності. Проте є дані про віддалені наслідки ГРДС подібної етіології. Звісно, передусім увагу привертають наслідки інших коронавірусних інфекцій. Так, у близько половини хворих з SARS-CoV-1 і третини хворих з MERS ретикулярні зміни в легенях виявлялися через два тижні після початку хвороби і спостерігалися не менше місяця [5,6]. А от через 15 років після одужання зміни інтерстицію зберігалися лише у 4,6% пацієнтів [7].
Тож є основа для обережного оптимізму, хоча очевидно, що у пацієнтів старшого віку та тих, у кого вже є прояви фіброзу легень, прогресування змін інтерстицію більш імовірно призведуть до зменшення функціональної здатності легень.
Крім наслідків ГРДС, до ретикулярного фіброзу легень призводить велика група захворювань, яка включає декілька десятків нозологічних форм, найбільш серйозним з яких є ідіопатичний легеневий фіброз – захворювання, що характеризується несприятливим прогнозом та часто швидким прогресуванням. Неприємно, що фактори ризику ідіопатичного легеневого фіброзу і тяжкого перебігу COVID-19 є спільними – це чоловіча стать, старший вік, цукровий діабет [8].
До фіброзу призводять також усі пилові захворювання легень – тут тяжкість і швидкість прогресування залежить від типу пилового агенту. Є також токсичні альвеоліти. Загальний механізм запуску фіброзу поєднують з мікропошкодженням епітелію альвеол. Можливий механізм прогресування фіброзу навіть після припинення дії шкідливого агенту також пов’язують з впливом гіпоксії унаслідок самого фіброзу, тобто утворюється хибне коло: пошкодження – фіброз – гіпоксія – пошкодження – фіброз [9].
Окреме місце посідає пневмофіброз унаслідок туберкульозу легень. На жаль, в останні десятиліття залишковим змінам перенесеного туберкульозу легень та їхньому впливу на якість життя не приділялося достатньо уваги в усьому світі: фтизіатри були зайняті лікуванням активного туберкульозу, ефективність якого залишає бажати кращого. Між тим, прогресуючий пневмофіброз і бронхоектази після перенесеного туберкульозу з масивним ураженням легеневої паренхіми – часта ситуація у практиці фтизіатрів, пульмонологів і кардіологів. Ці наслідки не лише погіршують якість життя, але й можуть призвести до смерті навіть за відсутності активного запального процесу.
Загалом, фіброзуючі захворювання легень регулярно зустрічаються у клінічній практиці, хоча назвати точні статистичні дані, принаймні в Україні, важко. Зрозуміло, що приєднання COVID-19 до будь-якого з них збільшує ризик прогресування респіраторної недостатності і в процесі хвороби, і після одужання. Тому хворим з уже існуючим пневмофіброзом необхідно передусім особливо ретельно дотримуватися заходів профілактики респіраторної інфекції. Це не є новиною – такі самі рекомендації стосувалися профілактики грипу та інших респіраторних захворювань [10].
Чому ШВЛ замість лікувати, інколи чинить протилежний вплив?
Окреме питання: пневмофіброз унаслідок штучної вентиляції легень. Цей феномен також був відомий задовго до COVID-19. Як і в інших випадках пневмофіброзу, його пов’язують з мікропошкодженнями епітелію альвеол, у цьому випадку внаслідок перерастягення.
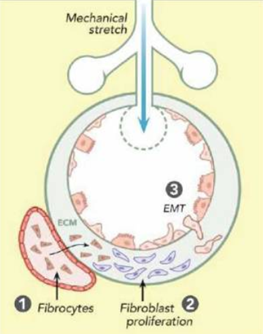 EMT – епітеліально-мезенхімальний перехід (epithelial– mesenchymal transition), ECM – позаклітинний матрікс (extracellular matrix)
EMT – епітеліально-мезенхімальний перехід (epithelial– mesenchymal transition), ECM – позаклітинний матрікс (extracellular matrix)
Механічне розтягнення альвеол призводить до (1) збільшення мобілізації циркулюючих фіброцитів до легень під дією цитокінів, що викликає локальний фіброз і (2) прискорення розвитку сполучної тканини, тож резидентні фібробласти можуть розмножуватися і брати участь у репаративному процесі та (3) епітеліально-мезенхімальному переході, тобто набутті мезенхімального фенотипу епітеліальними клітинами у процесі репарації. Є навіть термін «парадокс фіброзу», коли фіброз призводить до подовження ГРДС і критичного стану. У пацієнтів, які вмирають від ГРДС, є очевидні ознаки фіброзу, навіть якщо смерть наступає на відносно ранніх фазах.
Два важливі висновки, що випливають з «парадоксу фіброзу»
По-перше, дійсно ШВЛ може бути головним чинником розвитку фібропроліферативної відповіді.
По-друге, якомога більш швидке припинення ШВЛ може бути ключовим, хоча і недооціненим заходом, що забезпечує нормальне відновлення легень [11].
Як швидко люди відновлюються після COVID-19? Чим можна їм допомогти? Які стратегії реабілітації застосовуються?
Усвідомлення того, що роль COVID-19 у житті кожного хворого не вичерпується одужанням і потребує довгої реабілітації ще тільки приходить до фахівців та хворих. Навіть молоді спортсмени часто не можуть відновити толерантність до фізичного навантаження впродовж багатьох місяців. У відповідь на це, наприклад, система охорони здоров’я Великої Британії запускає мережу реабілітаційних центрів для осіб, які перенесли COVID-19.
Дізнайтеся більше: Які ще ускладнення виникають після COVID-19?
Вочевидь, фізична реабілітація є найбільш реалістичним підходом до покращення якості життя після одужання. Реабілітація завжди є складним багатоступінчатим процесом, який потребує ретельного нагляду з боку фахівців. Це не скасовує загальної парадигми – рання помірна фізична активність на тлі згасання запального процесу у легенях пришвидшує одужання.
Тетяна СТАСЕНКО, «ВЗ»
- Kim H, Hong H, Yoon SH. Diagnostic Performance of CT and Reverse Transcriptase-Polymerase Chain Reaction for Coronavirus Disease 2019: A Meta-Analysis. Radiology 2020:201343. doi: 10.1148/radiol.2020201343
- Стандарти медичної допомоги “Коронавірусна хвороба (COVID-19)”
- Zhang T, Sun LX, Feng RE [Comparison of clinical and pathological features between severe acute respiratory syndrome and coronavirus disease 2019]. Zhonghua Jie He He Hu Xi Za Zhi. 2020; 43: e040
- Mo X, Jian W, Su Z, Chen M, Peng H, Peng P, Lei C, Chen R, Zhong N and Li S: Abnormal pulmonary function in COVID-19 patients at time of hospital discharge. Eur Respir J. 55(2001217)2020.
- Ooi GC, Khong PL, Müller NL, Yiu WC, Zhou LJ, Ho JC, Lam B, Nicolaou S and Tsang KW: Severe acute respiratory syndrome: Temporal lung changes at thin-section CT in 30 patients. Radiology. 230:836–844. 2004.
- Das KM, Lee EY, Singh R, Enani MA, Al Dossari K, Van Gorkom K, Larsson SG and Langer RD: Follow-up chest radiographic findings in patients with MERS-CoV after recovery. Indian J Radiol Imaging. 27:342–349. 2017.
- Zhang P, Li J, Liu H, Han N, Ju J, Kou Y, Chen L, Jiang M, Pan F, Zheng Y, et al: Long-term bone and lung consequences associated with hospital-acquired severe acute respiratory syndrome: A 15-year follow-up from a prospective cohort study. Bone Res. 8(8)2020.
- George PM, Wells AU, Jenkins RG. Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy. Lancet Respir Med. 2020;8(8):807-815. doi:10.1016/S2213-2600(20)30225-3.
- Renzoni E, Srihari V, Sestini P. Pathogenesis of idiopathic pulmonary fibrosis: review of recent findings. F1000Prime Rep. 2014;6:69. Published 2014 Aug 1. doi:10.12703/P6-69
- Odashima K, Kagiyama N, Kanauchi T, Ishiguro T, Takayanagi N. Incidence and etiology of chronic pulmonary infections in patients with idiopathic pulmonary fibrosis. PLoS One. 2020;15(4):e0230746. Published 2020 Apr 3. doi:10.1371/journal.pone.0230746
- Cabrera-Benitez NE, Laffey JG, Parotto M, et al. Mechanical ventilation-associated lung fibrosis in acute respiratory distress syndrome: a significant contributor to poor outcome. Anesthesiology. 2014; 121(1):189-198. doi:10.1097/ALN.0000000000000264











