Хоча опіоїди — неймовірно ефективні знеболювальні, вони спричиняють надто небезпечні побічні ефекти, зокрема зумовлюють високий ризик розвитку залежності. Тому пошуки ефективного і з хорошою репутацією препарату, здатного подолати больовий синдром, тривають.

На щастя, дослідження з виявлення безпечніших опіоїдів почалися ще задовго до сучасної кризи, завдяки чому стало відомо, що всі ефекти опіоїдів пов’язані з впливом на відповідні рецептори нервових клітин. Опіоїдні рецептори — білки на зовнішній мембрані клітини, котрі регулюють больові відчуття, комплементарно зв’язуючись з опіоїдами. Загалом виділяють кілька груп опіоїдних рецепторів, найбільш вивчені з них — μ-(мю), δ-(дельта), κ-(капа) рецептори. Вони містяться в нейронах головного та спинного мозку, травного тракту і в деяких інших органах (табл. 1).
Будь-який опіоїдний препарат взає-модіє як ліганд із різними типами рецепторів. Хоча кожен засіб все-таки має певні уподобання, наприклад, морфін «любить» μ-рецептори. Опіоїдні рецептори також взаємодіють із G-протеїнпоєднаними рецепторами (GPCR — G-protein-coupled receptors), ще однією ланкою в біохімічному шляху розвитку болю.
Свого часу винайдення опіоїдних рецепторів змусило вчених замислитися над тим, яку роль вони відіграють без додаткового введення препаратів морфію, і сприяло відкриттю ендогенних опіоїдів, енкефалінів й ендорфінів. Ендогенні опіоїди, так само як і екзогенні, зв’язуються з опіоїдними рецепторами й забезпечують знеболювальний ефект. У ті дні відкриття ендорфінів викликало своєрідну ейфорію: було зроблено безліч спроб отримати їх синтетичні аналоги, речовини, які справляли б потужний аналгетичний ефект без несприятливих побічних явищ. На жаль, вони виявилися безрезультатними — усі отримані аналоги не перевершили морфіну. Фіаско здебільшого пояснюється надто складною біохімією опіоїдних рецепторів, але, на щастя, воно не остаточне.
Нова ланка
 Зв’язуючись із лігандом (ендорфіном, опіатом або іншою речовиною), опіоїдний рецептор змінює форму й запускає каскад внутрішньоклітинних реакцій. При цьому сам рецептор стає субстратом для ферментів-протеїнкіназ, які модифікують (фосфорилюють) деякі з його амінокислот. Такий змінений рецептор пов’язує вже інші протеїни, зокрема β-арестини. (Вважається, що ці сигнальні молекули задіяні в розвитку небезпечних побічних ефектів опіатів.)
Зв’язуючись із лігандом (ендорфіном, опіатом або іншою речовиною), опіоїдний рецептор змінює форму й запускає каскад внутрішньоклітинних реакцій. При цьому сам рецептор стає субстратом для ферментів-протеїнкіназ, які модифікують (фосфорилюють) деякі з його амінокислот. Такий змінений рецептор пов’язує вже інші протеїни, зокрема β-арестини. (Вважається, що ці сигнальні молекули задіяні в розвитку небезпечних побічних ефектів опіатів.)
Цитоплазматичний білок β-арестин відіграє важливу роль у гальмуванні клітинних реакцій, у тому числі тих, де до активації опіоїдних рецепторів залучені GPCR. β-арестини містяться в клітинах усіх тканин організму й завжди пов’язані з роботою мембранних рецепторів — активують або пригнічують їх дію. Як саме вони можуть призводити до розвитку небажаних ефектів, досі не з’ясовано. Щодо цього висунуто лише гіпотези, причому «синергічні»: різні запропоновані концепції не суперечать одна одній і можуть реалізовуватися одночасно.
Шлях до розробки кращих засобів
Найпопулярніша (і найсвіжіша) гіпотеза вказує, що рецептор, опіоїд і β-арестин утворюють потрійний комплекс. Він запускає каскад регуляторних процесів, які змінюють активність певних генів і протеїнів. Передусім це позначається на роботі іонних каналів, що «викачують» із клітини калій. Стрімка втрата калію спричиняє гіперполяризацію клітинної мембрани, і в такому стані клітина не здатна до генерації потенціалу дії та проведення імпульсів, отже, відбувається гальмування всіх процесів, до яких вона залучена. Наприклад, нейрон перестає відповідати на сигнали від шляхів, котрі проводять больові імпульси, і врешті-решт блокує відчуття болю. У такий спосіб клітина, яка перебуває під впливом опіату, задіяна у знеболюванні. Та паралельно вона втрачає чутливість до інших сигналів й, відповідно, генерує небажані побічні ефекти.
З урахування цих більш-менш вивчених механізмів сьогодні за допомогою різноманітних інноваційних стратегій розробляються нові, безпечніші опіоїди з максимумом знеболювальних властивостей і одночасно з меншим тягарем побічних ефектів. Кілька із цих багатообіцяючих розробок набрали обертів, а деякі з нових знеболювальних засобів навіть наближаються до клініки.
Агоністичний підхід
Однією з найбільш обговорюваних сьогодні стратегій є так званий упереджений агонізм — здатність рецептора диференційно активувати сигнальні шляхи залежно від зв’язування упереджених агоністів порівняно зі збалансованими. (Наприклад, опіоїди на кшталт фентанілу демонструють саме упереджений агонізм.)
Ця концепція була озвучена ще в 1999 році, коли в лінії мишей, виведених без внутрішньоклітинної сигнальної молекули β-арестину (а саме β-арестину 2), досліджували реакції на морфін. Тоді вчені встановили, що без β-арестину знеболювальна відповідь була фактично сильнішою та тривалішою. При цьому толерантність у тварин не розвивалася.
Також у мишей не було зафіксовано порушень з боку дихальної та травної систем. Це відкриття підказало ідею полегшення болю шляхом штучної корекції зв’язування β-арестинів з опіоїдними рецепторами. Проте такий підхід все ж не був позбавлений несприятливих побічних ефектів.
У цьому напрямку й досі працюють фармакологи із дослідницького інституту «Скріпс» штату Флорида (США): вони шукають препарат, який змінить форму рецептора, щоб досягти безпечного полегшення болю. Вони визначили 6 агоністів μ-рецептора на основі піперидину, котрі забезпечували ефективне полегшення болю з меншою кількістю побічних ефектів і меншим ризиком розвитку толерантності. Утім, автори не впевнені, чи стане хоча б одна із вказаних молекул магічною таблеткою. Та досліди тривають, і це вже можна вважати прогресом.
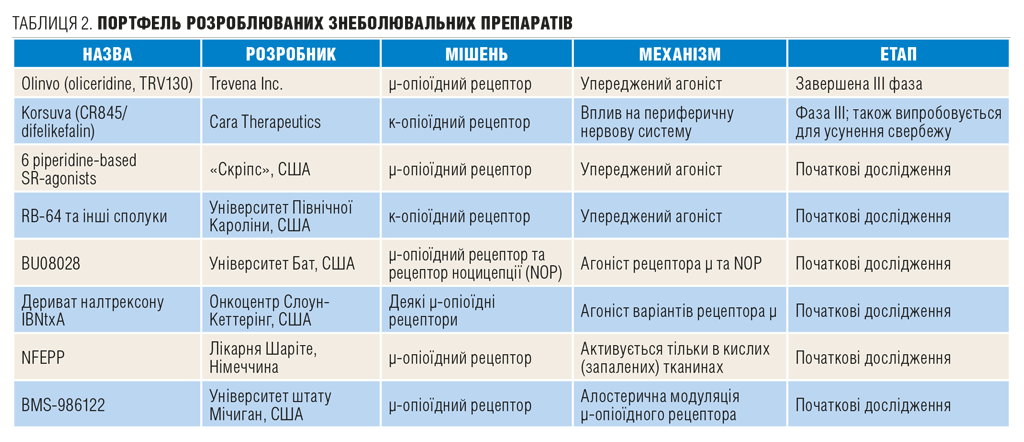
Нещодавно ця група зробила значний крок уперед: виділила опіат оліцеридин (TRV130, Olinvo), дія якого ґрунтується на принципі упередженого агонізму. Результати попередніх досліджень показали його переваги над існуючими опіоїдами, тож розробники «ставлять» на цього кандидата. Результати досліджень II фази продемострували здатність препарату забезпечити ефективну й швидку аналгезію у пацієнтів з помірним або вираженим післяопераційним болем, а також його прийнятний профіль безпечності/переносимості й наявність потенційно ширшого терапевтичного вікна порівняно з морфіном. Та все ж подальші результати не можна назвати блискучими: III фаза за участю пацієнтів, котрі перенесли хірургічне втручання, продемонструвала незначні переваги препарату перед традиційними опіоїдами.
Утім, TRV130 залишається єдиним аналогом морфіну, який був випробуваний на пацієнтах. Поки фахівці проявляють помірний оптимізм щодо новинки: у медицині відомо чимало прикладів, коли настільки ж багатообіцяючі розробки закінчувалися нічим. Один з нещодавніх — молекула PZM21, створена за допомогою комп’ютерного моделювання. На початку драг-дизайну її автори отримали більше 3 млн віртуальних молекул, які за структурою підходили для ефективного зв’язування з μ-рецептором. Відбираючи найперспективніші варіанти, дослідники крок за кроком скоротили це число до 2,5 тис., потім — до 23 і нарешті всього до 7 сполук, котрі демонстрували найвищу спорідненість до μ-рецептора.
Згодом вони визначилися з фаворитом: автори сподівалися, що PZM21 стане знаменитістю світового масштабу, адже вона не лише з’єднувалася з μ-рецептором, а й змінювала його конформацію так, що дезактивувала β-арестин навіть після фосфорилювання. Це давало надію на те, що вдасться позбутися всіх побічних ефектів опіатів, зокрема фізичної та психічної залежності. Досліди на тваринах підбадьорили вчених, але, на жаль, дані 2018 року розбили їх мрії вщент. Останні роботи доводять: PZM21 — не дуже ефективний агоніст μ-рецептора. До того ж виявилося, що PZM21 пригнічує дихання подібно до морфіну.
Зміна ракурсу
Іншою стратегією пошуку безпечних опіоїдів стало вибіркове націлення на альтернативні опіоїдні рецептори. Річ у тім, що майже всі наявні на сьогодні знеболювальні «чіпляються» до μ, хоча доведено: різні шляхи знеболювання забезпечують й інші рецептори, зокрема δ та κ. Сполуки, специфічні до них, менше впливають на центральну нервову систему і відповідно спричиняють менше побічних ефектів (включаючи звикання), притаманних агоністам μ-рецепторів.
Ця стратегія вперше досліджена теж доволі давно, у 80-х роках минулого століття, але початкові спроби виявилися не дуже вдалими: випробовувані засоби спричиняли психотичні розлади та деякі інші побічні ефекти, настільки несприятливі, що про цей підхід надовго забули. Та сьогодні він повертається із новим потенційним болезаспокійливим препаратом дифелікефаліном (брендова назва Korsuva), котрий планується застосовувати перорально й ін’єкційно (табл. 2). За словами виробника, Korsuva допомагає уникнути побічних явищ з боку ЦНС за рахунок того, що κ-рецептори розташовані в імунних клітинах та спинному мозку (на гангліях заднього корінця). Отже, агоністи κ-опіоїдних рецепторів (KORAs) знеболюють за рахунок впливу на периферичну нервову систему і відповідно не спричиняють виражених побічних ефектів, опосередкованих ЦНС. Утім, результати досліджень дифелікефаліну неоднозначні.
Паралельно розробляють інші селективні опіоїди — ті, котрі вибірково активують інші рецептори, а саме субтип μ-рецептора. (Протягом останнього десятиліття виявилося, що існують варіанти μ-рецепторів.) Наразі максимально потужний серед них — аналгетик широкого спектра дії IBNtxA (3-йодбензоїл-6β-налтрексамін), похідний налтрексону. Він теж ніби запобігає розвитку фізичної залежності та толерантності, принаймні, меншою мірою, ніж морфін. Поки IBNtxA випробовують на тваринах і невідомо, коли його дозволять вводити людям.
Кислотний тригер
 Деякі вчені працюють над розробкою локальнішого підходу до опіоїдної аналгезії, що також дасть змогу уникнути виражених побічних ефектів з боку ЦНС. Наприклад, німецькі анестезіологи розробили молекулу, яка виявляє активність лише в кислих умовах: було встановлено, що багато різних типів ушкоджень, котрі супроводжуються болем, характеризуються ацидозом тканин. Отже, основоположна ідея полягає в тому, що активна сполука не активує рецепторів у головному мозку, оскільки він не є кислим середовищем, й, відповідно, не спричиняє несприятливих ефектів.
Деякі вчені працюють над розробкою локальнішого підходу до опіоїдної аналгезії, що також дасть змогу уникнути виражених побічних ефектів з боку ЦНС. Наприклад, німецькі анестезіологи розробили молекулу, яка виявляє активність лише в кислих умовах: було встановлено, що багато різних типів ушкоджень, котрі супроводжуються болем, характеризуються ацидозом тканин. Отже, основоположна ідея полягає в тому, що активна сполука не активує рецепторів у головному мозку, оскільки він не є кислим середовищем, й, відповідно, не спричиняє несприятливих ефектів.
Вчені почали розвивати цю ідею з молекули фентанілу: за допомогою комп’ютерного моделювання вони встановили, як можна створити аналог, що буде зв’язуватися з рецептором лише в кислих умовах. Так з’явилася NFEPP, похідна фентанілу, котра в дослідах на щурах не призводила до небезпечних реакцій навіть у великих дозах.
Різні вектори
Європейські фахівці розвивають кілька інших стратегій, включаючи поліфармакологічні підходи. Зокрема, вчені з Великої Британії розробили агоністи μ-рецепторів BU08028 — окрім μ-рецепторів молекула впливає на активність ноцицептину, ендогенного ліганду ноцицептивних рецепторів. Деякі такі біфункціональні молекули в дослідах на приматах забезпечували ефективне полегшення болю без звичайних побічних ефектів опіоїдів.
Ще одну надію дає відкриття особливої групи ендогенних опіоїдів, коротких пептидів ендоморфінів, які впливають на μ-рецептори, запускаючи знеболювання без побічних явищ.
Надзвичайно важливо, що проблему адекватного знеболювання вчені намагаються вирішити, рухаючись абсолютно різними шляхами. І поки одні моделюють і випробовують нові молекули, інші «доопрацьовують» уже існуючі.
Звісно, говорити про ідеальні аналгезивні молекули поки зарано, усі нові розробки потребують додаткових і всебічних досліджень, а це — не один рік. Але вже зараз зрозуміло, що вчені заклали серйозний базис для подальших відкриттів, а пацієнти та їх лікарі отримали надію на абсолютну свободу від болю й залежності.
Підготувала Любомира ПРОТАСЮК, спеціально для «ВЗ»











