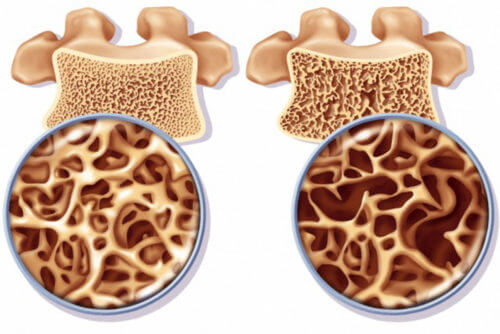
 На думку ВООЗ, остеопороз набуває статусу епідемії — кількість остеопоротичних переломів у світі збільшується і у 2050 р. зросте до 6,3 млн. Статистика України також невтішна: на остеопороз хворіють 2,5 млн жінок та 900 тис. чоловіків, половина внаслідок захворювання стає інвалідами, 20% помирають від ускладнень цієї хвороби. У жінок ризик смерті від ускладнень остеопорозу становить 3,7% (для порівняння: від раку молочної залози — 2,6%). При цьому після досягнення жінкою 50 років ризик виникнення остеопоротичного перелому стегнової кістки дорівнює сумарному ризику виникнення раку молочної залози, матки та яєчників. У віці понад 50 років 4 з 10 жінок мають остеопоротичні переломи. Найчастіше зустрічаються переломи тіл хребців, стегнової кістки, а найтиповішим для жінок цього віку є перелом кісток передпліччя. Така ситуація вимагає пошуку оптимальних діагностичних технологій, які дозволять вчасно виявляти захворювання.
На думку ВООЗ, остеопороз набуває статусу епідемії — кількість остеопоротичних переломів у світі збільшується і у 2050 р. зросте до 6,3 млн. Статистика України також невтішна: на остеопороз хворіють 2,5 млн жінок та 900 тис. чоловіків, половина внаслідок захворювання стає інвалідами, 20% помирають від ускладнень цієї хвороби. У жінок ризик смерті від ускладнень остеопорозу становить 3,7% (для порівняння: від раку молочної залози — 2,6%). При цьому після досягнення жінкою 50 років ризик виникнення остеопоротичного перелому стегнової кістки дорівнює сумарному ризику виникнення раку молочної залози, матки та яєчників. У віці понад 50 років 4 з 10 жінок мають остеопоротичні переломи. Найчастіше зустрічаються переломи тіл хребців, стегнової кістки, а найтиповішим для жінок цього віку є перелом кісток передпліччя. Така ситуація вимагає пошуку оптимальних діагностичних технологій, які дозволять вчасно виявляти захворювання.
Ненадійне минуле
Для діагностики остеопорозу в рутинній клінічній практиці зазвичай виконуються рентгенограми найбільш схильних до цього процесу ділянок скелета: грудного та поперекового відділів хребта (обов’язково у двох проекціях), тазостегнових суглобів, кистей і дистальних відділів променевої кістки. На оглядових рентгенограмах роздільно вивчаються як кортикальні, так і трабекулярні ділянки скелета. Загальна характеристика трабекулярної зони при остеопорозі може бути охарактеризована як кістка підвищеної прозорості, адже кількість трабекул в одиниці площі рентгенограми зменшена. Однак подібна загальна оцінка рентгенівського знімка тільки на основі зорового сприйняття прозорості кісткової тканини надзвичайно суб’єктивна. Внаслідок відомих особливостей роботи людського зорового аналізатора помилка в діагностиці остеопорозу по рентгенограмах може досягати 30-40%.
«Золоті» стандарти сьогодення
Денситометрія — вимірювання щільності кісткової тканини, засноване на вимірюванні мінерального компонента кісткової тканини — кальцію. Застосовуються ізотопні (моно- і двохфотонна абсорбціометрія), рентгенівські (моно- і двохенергетична абсорбціометрія, кількісна комп’ютерна томографія) і ультразвукові методи. За допомогою монофотонної, моноенергетичної та ультразвукової денситометрії досліджують периферичні відділи скелета. Ці методи найбільш підходять для скринінгу остеопорозу або попереднього діагнозу. Найбільш універсальним є застосування двохенергетичної рентгенівської абсорбціометрії (DEXA). Це «золотий стандарт», що дозволяє вимірювати вміст кісткового мінералу в будь-якій ділянці скелета, а також визначати вміст солей кальцію, жиру і м’язової маси у всьому організмі. Стандартними (автоматичними) програмами для таких денситометрів є програми для поперекових хребців, проксимальних відділів стегна, кісток передпліччя і програма «Все тіло».
Але денситометрії мають суттєві недоліки. По-перше, діагностика остеопорозу можлива лише за часткової втрати кісткової маси. По-друге, метод не дозволяє прогнозувати рівень втрати кісткової маси. По-третє — оцінка зміни щільності кісткової тканини можлива тільки через 1,5-2 роки після призначення терапії. А отже можливості швидкої корекції терапії остеопорозу немає.
Біохімічні маркери остеопорозу
Швидкість утворення або руйнування матриксу кісткової тканини може оцінюватися чи при вимірі активності специфічних ферментів кісткоутворюючих або кісткоруйнуючих клітин чи шляхом визначення компонентів, що надходять у кровотік під час синтезу або резорбції кістки. Ці показники поділяються на маркери синтезу та резорбції кістки. Визначення рівня біохімічних маркерів дозволяє під час профілактичного обстеження виявити пацієнтів з метаболічними порушеннями процесів ремоделювання і резорбції кісткової тканини, оцінити і спрогнозувати рівень втрати кісткової маси, вибрати найбільш ефективний препарат і визначити оптимальну дозу індивідуально для кожного пацієнта, а також дати оцінку ефективності призначеної терапії вже через 2-3 місяці. Біохімічні маркери також використовуються для розв’язання питання про необхідність лікарської терапії у жінок після менопаузи: чим вище значення кісткового метаболізму і чим нижча величина кісткової щільності порівняно з нормальними значеннями, тим більша необхідність призначення лікарської терапії. Окрім цього, результати багатьох клінічних випробувань дозволяють зробити висновок, що маркери кісткового метаболізму можуть використовуватися для прогнозування дії антитерапії на масу кісткової тканини.
Основний маркер кісткового ремоделювання — лужна фосфатаза кісткового походження, яка міститься в мембрані остеобластів. Найчастіше використовується загальна активність лужної фосфатази в сироватці, але цим показникам властива низька чутливість і специфічність. Причини істотного підвищення сироваткового рівня лужної фосфатази — різні. Наприклад, у літніх пацієнтів це може бути наслідком дефекту мінералізації кісткової тканини або впливу одного з багатьох лікарських препаратів, які здатні підвищувати активність печінкового ізоферменту. Адекватним маркером швидкості ремоделювання кістки вважається остеокальцин. Це так званий кістковий gla-протеїн, що синтезується переважно остеобластами і включається в позаклітинний матрикс кісткової тканини. Частина цього білка проникає в кровотік, де може вимірюватися імунними методами.
Дослідження підтверджують, що підвищення рівня лужної фосфатази й остеокальцину в сироватці крові часто відзначається під час лікування пацієнтів з остеопорозом фторидами. Тому визначення маркерів рекомендовано для контролю за стимулюючим впливом цих речовин. Окрім цих двох факторів є інноваційні і сучасні біохімічні маркери остеопорозу. Наприклад, набуває діагностичної цінності Total PINP (N-термінальний пропептид проколагена I), що відображає інтенсивність формування кісткової тканини; TRAP 5b-тартат резистентна КФ (ізоформа 5b), яка свідчить про активність остеобластів, та RANKL/OPG — маркер, що показує ступінь ремодулювання, ризик-фактор порушення процесу та «відслідковувач» ефекту терапії.
Основний біохімічний маркер кісткової резорбції — деоксіпірідонолін (ДПІД), що є перехресним піридиновим зв’язком, притаманним зрілому колагену, і не піддається подальшим метаболічним перетворенням. Він виводиться з сечею у вільній формі (близько 40%) і у зв’язаному з пептидами вигляді (60%). Визначення ДПІД у сечі має ряд переваг: високу специфічність для обміну кісткової тканини, відсутність метаболічних перетворень до виведення з сечею та можливість проведення дослідження без попередніх дієтичних обмежень.
Інший важливий маркер резорбції — beta-CrossLaps. Це С-кінцеві телопептиди, що утворюються при деградації колагену 1 типу, який становить більше 90% органічного матриксу кістки. Вимірювання beta-CrossLaps дозволяє оцінити темпи деградації «старої» кісткової тканини. У нормі малі фрагменти колагену, що утворюються у разі його деградації, надходять у кров і виводяться нирками із сечею. У пацієнтів зі зниженою функцією нирок вміст beta-CrossLaps у сироватці крові зростає внаслідок зниження екскреції. У разі патологічного збільшення резорбції кісткової тканини (похилий вік, остеопороз) колаген 1 типу деградує у великому обсязі, що призводить до збільшення рівня фрагментів колагену в крові.
Інвазивні методи діагностики
Корисну інформацію про обмін кісткової тканини дають деякі інвазивні методи. Гістоморфологічний аналіз гребеня клубової кістки дає можливість отримати відомості про швидкість утворення кісткової тканини на клітинному і тканинному рівні, проте інформації про величину кісткової резорбції недостатньо. Крім того, дослідження обміну кісткової тканини обмежується невеликою ділянкою губчастої речовини і внутрішньою поверхнею кортикального шару, а це не завжди відображає те, що відбувається в інших відділах скелета.
Тетяна ПРИХОДЬКО, «ВЗ»











